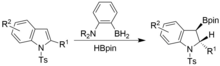Par frustrado de Lewis - Frustrated Lewis pair
Em química, um par de Lewis frustrado ( FLP ) é um composto ou mistura contendo um ácido de Lewis e uma base de Lewis que, devido ao impedimento estérico , não pode se combinar para formar um aduto clássico . Muitos tipos de FLPs foram concebidos e muitos substratos simples exibem ativação.
A descoberta de que alguns FLPs dividem H 2 desencadeou um rápido crescimento da pesquisa em FLPs. Por causa de sua reatividade "não extinta", tais sistemas são reativos para substratos que podem sofrer heterólise . Por exemplo, muitos FLPs dividem moléculas de hidrogênio . Assim, uma mistura de triciclohexilfosfina (PCy 3 ) e tris (pentafluorofenil) borano reage com hidrogênio para dar os respectivos íons fosfônio e borato :
Esta reatividade foi explorada para produzir FLPs que catalisam reações de hidrogenação .
Ativação de moléculas pequenas
Foi demonstrado que pares de Lewis frustrados ativam muitas moléculas pequenas, tanto por indução de heterólise quanto por coordenação.
Hidrogênio
A descoberta de que alguns FLPs são capazes de se dividir e, portanto, ativar o H 2, desencadeou um rápido crescimento da pesquisa nessa área. A ativação e, portanto, o uso de H 2 é importante para muitas transformações químicas e biológicas. O uso de FLPs para liberar H 2 é isento de metal, o que é benéfico devido ao custo e ao fornecimento limitado de alguns metais de transição comumente usados para ativar o H 2 (Ni, Pd, Pt). Os sistemas FLP são reativos para substratos que podem sofrer heterólise (por exemplo, hidrogênio) devido à reatividade "não extinta" de tais sistemas. Por exemplo, foi anteriormente demonstrado que uma mistura de triciclohexilfosfina (PCy 3 ) e tris (pentafluorofenil) borano reage com H 2 para dar os respectivos íons fosfônio e borato :
Nesta reação, PCy 3 (a Base de Lewis) e B (C 6 F 5 ) 3 (o ácido de Lewis) não podem formar um aduto devido ao impedimento estérico dos grupos ciclohexil e pentafluorofenil volumosos. O próton no fósforo e o hidreto do borato são agora "ativados" e podem ser subsequentemente "entregues" a um substrato orgânico, resultando em hidrogenação .
Mecanismo de ativação de dihidrogênio por FLP
O mecanismo para a ativação de H 2 por FLPs tem sido discutido para os casos intermoleculares e intramoleculares. FLPs intermoleculares são onde a base de Lewis é uma molécula separada do ácido de Lewis, acredita-se que essas moléculas individuais interagem por meio de interações de dispersão secundária de London para reunir a base de Lewis e o ácido (um efeito pré-organizacional) onde pequenas moléculas podem interagir com os FLPs. A evidência experimental para este tipo de interação em nível molecular não é clara. No entanto, há evidências de apoio para este tipo de interação com base em estudos computacionais DFT (Density Functional Theory). FLPs intramoleculares são onde o ácido de Lewis e a base de Lewis são combinados em uma molécula por um ligante covalente. Apesar dos "efeitos pré-organizacionais" melhorados, acredita-se que estruturas FLP intramoleculares rígidas tenham uma reatividade reduzida a moléculas pequenas devido a uma redução na flexibilidade.
Outros substratos de moléculas pequenas
FLPs também são reativos para muitos substratos insaturados além de H 2 . Alguns FLPs reagem com o CO 2 , especificamente na redução desoxigenativa do CO 2 em metano.
O etileno também reage com FLPs:
Para que os pares de ácido-base se comportem tanto nucleofilicamente quanto eletrofilicamente ao mesmo tempo, oferece um método para a abertura do anel de éteres cíclicos, como THF, 2,5-dihidrofurano, cumarano e dioxano.
Use em catálise
Hidrogenação de imina, nitrila e aziridina
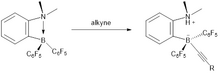
A redução de iminas , nitrilas e aziridinas em aminas primárias e secundárias é tradicionalmente efetuada por reagentes de hidreto de metal, por exemplo, hidreto de alumínio e lítio e cianoboro-hidreto de sódio . As hidrogenações desses substratos insaturados podem ser efetuadas por reações catalisadas por metal. A hidrogenação catalítica sem metal foi realizada usando o catalisador de borato de fosfônio (R 2 PH) (C 6 F 4 ) BH (C 6 F 5 ) 2 (R = 2,4,6-Me 3 C 6 H 2 ) 1 . Este tipo de hidrogenação sem metal tem o potencial de substituir o catalisador de metal de alto custo.
O mecanismo de redução de imina é proposto para envolver a protonação do nitrogênio dando o sal de imínio. A basicidade do centro de nitrogênio determina a taxa de reação. Mais iminas ricas em elétrons reduzem a taxas mais rápidas do que iminas pobres em elétrons. O centro de imínio resultante sofre ataque nucleofílico pelo ânion boro-hidreto para formar a amina. Pequenas aminas ligam-se ao borano, extinguindo outras reações. Este problema pode ser superado usando vários métodos: 1) Aplicação de temperaturas elevadas 2) Usando substituintes de imina estericamente volumosos 3) Protegendo a imina com o grupo B (C 6 F 5 ) 3 , que também serve como um promotor de ácido de Lewis.
Hidrogenação de imina enantiosseletiva
Boronato quiral ácido de Lewis derivado a partir de (1 R ) - ( + ) -canfor formar um par de Lewis frustrado com t Bu 3 P, que é isolável como um sal. Este FLP catalisa a hidrogenação enantiosseletiva de algumas ariliminas com alto rendimento, mas modesto ee (até 83%).
Embora conceitualmente interessante, o protocolo sofre de falta de generalidade. Verificou-se que aumentando a massa estérica das imina substituintes levar à diminuição do rendimento e ee da amina produto. as iminas substituídas com metoxi exibem rendimento e ee ' s superiores.
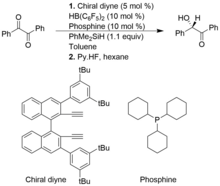
Hidrossililações assimétricas
Um grupo de catalisadores, pares Lewis frustrados de alquenilboranos e fosfinas quirais são benéficos para hidrossililações do tipo Piers assimétricas de compostos 1,2-dicarbonil e alfa-ceto ésteres, resultando em produtos de enantiosseletividade de alto rendimento. No entanto, em comparação com a hidrossililação convencional do tipo Piers, as hidrossililações assimétricas do tipo Piers não são tão bem desenvolvidas
No exemplo a seguir, o alquenilborano quiral é formado in situ a partir de diino quiral e o HB (C 6 F 5 ) 2 . A clivagem heterolítica da ligação Si-H de PhMe 2 SiH pelo catalisador FLP, forma um complexo iônico de silílio e hidridoborato.
Hidrogenação de alcino
A hidrogenação livre de metal de alcinos internos não ativados em cis- alcenos é facilmente alcançada usando catalisadores baseados em FLP. A condição para esta reacção foram relativamente suaves utilizando 2 bar de H 2 . Em termos de mecanismo, o material alcino é primeiro hidroborado e, em seguida, o FLP à base de vinilborano resultante pode então ativar o di-hidrogênio. Uma etapa de protodeborilação libera o produto cis- alceno, que é obtido devido ao processo de sin- hidroborilação e regenerando o catalisador. Embora ativos para hidrogenação de alcino, os catalisadores baseados em FLP não facilitam, entretanto, a hidrogenação de alcenos em alcanos.
A reação é uma sin-hidroboração e, como resultado, uma alta seletividade cis é observada. No estágio final do ciclo catalítico, o grupo C 6 F 5 é clivado mais facilmente do que um grupo alquila, causando degradação do catalisador em vez de liberação de alcano. O ciclo catalítico tem três etapas:
- Ligação de substrato (a hidroboração de alcino)
- Clivagem de H 2 com vinilborano, seguida por protodeborilação intramolecular do substituinte de vinil, recuperando N, N-Dimetil-2 - [(pentafluorofenil) boril] anilina
- Liberação do cis-alceno
Com alcinos internos, uma reação competitiva ocorre onde o próton ligado ao nitrogênio pode ser adicionado aos fluorobenzenos. Portanto, esta adição não avança muito, a formação do alceno parece favorecida.
Mas os alcinos terminais não se ligam ao boro por meio da hidroboração, mas pela ativação do CH. Assim, a adição do próton ao alcino resultará no alcino terminal inicial. Portanto, este processo de hidrogenação não é adequado para alcinos terminais e dará apenas pentafluorobenzeno.
A hidrogenação livre de metal de alcinos terminais para os respectivos alcenos foi recentemente alcançada usando um sistema baseado em piridona borano. Este sistema ativa o hidrogênio prontamente à temperatura ambiente produzindo um complexo de piridona borano. A dissociação deste complexo permite a hidroboração de um alcino pelo borano livre. Após a protodeborilação pela piridona livre, o alceno cis é gerado. A hidrogenação de alcinos terminais é possível com este sistema, pois a ativação do CH é reversível e compete com a ativação do hidrogênio.
Borylation
FLPs de amina-borano catalisam a borilação de heterociclos aromáticos ricos em elétrons (Esquema 1). A reação é conduzida pela liberação de hidrogênio via ativação CH pelo FLP. Borilações aromáticas são frequentemente utilizadas no desenvolvimento farmacêutico, particularmente devido à abundância, baixo custo e baixa toxicidade dos compostos de boro em comparação com os metais nobres.,
O substrato para a reação tem dois requisitos principais, fortemente ligados ao mecanismo de borylation. Primeiramente, o substrato deve ser rico em elétrons, exemplificado pela ausência de reação com o tiofeno, enquanto seus derivados mais ricos em elétrons - metoxitiofeno e 3,4-etilenodioxitiofeno - podem sofrer reação com o aminoborano. Além disso, a substituição de 1-metilpirrol (que pode reagir) com o grupo terc-butiloxicarbonil (Boc) que retira fortemente o elétron na posição 2 inibe completamente a reação. O segundo requisito é a ausência de grupos amina básicos no substrato, que de outra forma formariam um aduto indesejado. Isso pode ser ilustrado pela falta de reação com o pirrol, enquanto os derivados de 1-metil e N-benzilpirrol são capazes de reagir.
Trabalhos adicionais dos mesmos autores revelaram que simplesmente a piperidina como grupo R da amina (em oposição à tetrametilpiperidina, na foto acima) acelerou a taxa de reação. Por meio de estudos cinéticos e DFT, os autores propuseram que a etapa de ativação do CH era mais fácil do que com substituintes maiores.
A querosomatização também pode ser alcançada em condições semelhantes, mas usando N-tosil indóis. São obtidas indolinas Syn- hidroboriladas.
A borilação de ligações SH em tióis por um processo desidrogenativo também foi observada. Álcoois e aminas, como terc-butanol e tert-butilamina, formam produtos estáveis que impedem a catálise devido a uma forte ligação π entre o par solitário do átomo de N / O e o boro, enquanto o mesmo não é verdadeiro para tióis, permitindo assim uma catálise bem-sucedida . Além disso, foi alcançada a borilação bem-sucedida de ligações Se-H. Em todos os casos, a formação de gás H 2 é uma grande força motriz para as reações.
Captura de carbono
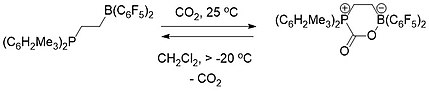
A química FLP é conceitualmente relevante para a captura de carbono . Ambos um FLP intermolecular (Esquema 1) e intramolecular (Esquema 2) consistindo em uma fosfina e um borano foram usados para capturar e liberar seletivamente dióxido de carbono. Quando uma solução do FLP foi coberta por uma atmosfera de CO 2 à temperatura ambiente, o composto FLP-CO 2 precipitou imediatamente como um sólido branco.
O aquecimento do composto intermolecular FLP-CO 2 em bromobenzeno a 80 ° C sob vácuo por 5 horas causou a liberação de cerca de metade do CO 2 e regeneração dos dois componentes constituintes do FLP. Depois de mais algumas horas sentado à temperatura ambiente sob vácuo, ocorreu a liberação total de CO 2 e a regeneração do FLP.
O composto FLP-CO 2 intramolecular , por contraste, era estável como um sólido à temperatura ambiente, mas se decompunha totalmente a temperaturas acima de -20 ° C como uma solução em diclorometano liberando CO 2 e regenerando a molécula de FLP.
Este método de captura de carbono FLP pode ser adaptado para funcionar em sistemas de química de fluxo.

![{\ displaystyle {\ ce {PCy3 + B (C6F5) 3 + H2 -> [HPCy3] + [HB (C6F5) 3] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)