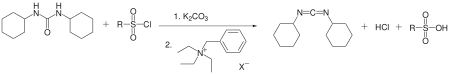
N , N ' -Diciclohexilcarbodiimida - N,N'-Dicyclohexylcarbodiimide
|
|

|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC preferido
N , N '-Diciclohexilmetanodiimina |
|
| Outros nomes
Diciclohexilmetanodiimina
N , N '-Diciclohexilcarbodiimida DCC, DCCD, DCCI |
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| 610662 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard |
100,007,914 |
| Número EC | |
| 51651 | |
|
PubChem CID
|
|
| Número RTECS | |
| UNII | |
| Número ONU | 2811 |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| C 13 H 22 N 2 | |
| Massa molar | 206,333 g · mol −1 |
| Aparência | pó cristalino branco |
| Densidade | 1,325 g / cm 3 , sólido |
| Ponto de fusão | 34 ° C (93 ° F; 307 K) |
| Ponto de ebulição | 122 ° C (252 ° F; 395 K) (a 6 mmHg) |
| não solúvel | |
| Perigos | |
| Pictogramas GHS |
  
|
| Palavra-sinal GHS | Perigo |
| H302 , H311 , H317 , H318 | |
| P261 , P264 , P270 , P272 , P280 , P301 + 312 , P302 + 352 , P305 + 351 + 338 , P310 , P312 , P321 , P322 , P330 , P333 + 313 , P361 , P363 , P405 , P501 | |
| NFPA 704 (diamante de fogo) | |
| Ponto de inflamação | 113 ° C (235 ° F; 386 K) |
| Compostos relacionados | |
|
Carbodiimidas relacionadas
|
DIC , EDC |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referências da Infobox | |
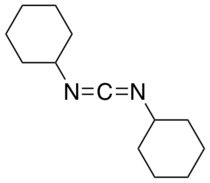
N , N ′ -Diciclohexilcarbodiimida ( DCC ou DCCD ) é um composto orgânico com a fórmula química (C 6 H 11 N) 2 C. É um sólido branco ceroso com um odor adocicado. Seu uso principal é acoplar aminoácidos durante a síntese artificial de peptídeos . O baixo ponto de fusão deste material permite que ele seja derretido para fácil manuseio. É altamente solúvel em diclorometano , tetrahidrofurano , acetonitrila e dimetilformamida , mas insolúvel em água .
Estrutura e espectroscopia
O núcleo CN = C = NC das carbodiimidas (N = C = N) é linear, estando relacionado à estrutura do aleno . A molécula idealizou a simetria C 2 .
A porção N = C = N dá assinatura espectroscópica IV característica em 2117 cm -1 . O espectro de 15 N NMR mostra um deslocamento característico de 275 ppm no campo superior de ácido nítrico e o espectro de 13 C NMR apresenta um pico em cerca de 139 ppm no campo abaixo de TMS.
Preparação
O DCC é produzido pela descarboxilação de isocianato de ciclohexila usando óxidos de fosfina como catalisador:
- C 6 H 11 NCO → (C 6 H 11 N) 2 C + CO 2
Catalisadores alternativos para esta conversão incluem OP altamente nucleofílico (MeNCH 2 CH 2 ) 3 N.
Outros métodos
De interesse acadêmico, acetato de paládio , iodo e oxigênio para acoplar ciclohexilamina e ciclohexil isocianeto . Rendimentos de até 67% foram alcançados usando esta rota:
- C 6 H 11 NC + C 6 H 11 NH 2 + O 2 → (C 6 H 11 N) 2 C + H 2 O
O DCC também foi preparado a partir de diciclohexilureia usando um catalisador de transferência de fase . A ureia dissubstituída, o cloreto de arenossulfonilo e o carbonato de potássio reagem em tolueno na presença de cloreto de benzil trietilamónio para dar DCC com um rendimento de 50%.
Reações
Formação de amida, peptídeo e éster
DCC é um agente desidratante para a preparação de amidas , cetonas e nitrilos . Nessas reações, o DCC se hidrata para formar diciclohexilureia (DCU), um composto quase insolúvel na maioria dos solventes orgânicos e insolúvel em água. A maioria do DCU é, portanto, facilmente removida por filtração, embora os últimos traços possam ser difíceis de eliminar em produtos não polares. O DCC também pode ser usado para inverter álcoois secundários . Na esterificação de Steglich , os álcoois, incluindo até mesmo alguns álcoois terciários, podem ser esterificados usando um ácido carboxílico na presença de DCC e uma quantidade catalítica de DMAP .
Na síntese de proteínas (como os sintetizadores de estado sólido Fmoc ), o N-terminal é frequentemente usado como o local de ligação ao qual os monômeros de aminoácidos são adicionados. Para aumentar a eletrofilicidade do grupo carboxilato , o oxigênio carregado negativamente deve primeiro ser "ativado" em um grupo de saída melhor . O DCC é usado para esse propósito. O oxigênio carregado negativamente atuará como um nucleófilo , atacando o carbono central no DCC. O DCC está temporariamente ligado ao antigo grupo carboxilato formando um intermediário altamente eletrofílico, tornando o ataque nucleofílico pelo grupo amino terminal no peptídeo em crescimento mais eficiente.
Oxidação Moffatt
Em combinação com dimetilsulfóxido (DMSO), DCC efetua a oxidação de Pfitzner-Moffatt . Este procedimento é usado para a oxidação de álcoois em aldeídos e cetonas. Ao contrário das oxidações mediadas por metais , como a oxidação de Jones , as condições de reação são suaves o suficiente para evitar a oxidação excessiva de aldeídos em ácidos carboxílicos. Geralmente, três equivalentes de DCC e 0,5 equivalente de fonte de prótons em DMSO são deixados reagir durante a noite à temperatura ambiente. A reação é extinta com ácido.
Outras reações
- A reação de um ácido com peróxido de hidrogênio na presença de DCC leva à formação de ligação de peróxido.
- Os álcoois também podem ser desidratados usando DCC. Esta reação prossegue dando primeiro o intermediário O-acilureia que é então hidrogenolisado para produzir o alceno correspondente:
- RCHOHCH2R '+ C 6 H 11 N) 2 C → RCH = CHR' + (C 6 H 11 NH) 2 CO
- Os álcoois secundários podem ser estereoquimicamente invertidos pela formação de um éster formílico seguido de saponificação . O álcool secundário é misturado diretamente com DCC, ácido fórmico e uma base forte, como metóxido de sódio .
Ação biológica
DCC é um inibidor clássico da ATP sintase . DCC inibe ATP sintase através da ligação a um dos c subunidades e causar impedimento estérico da rotação do F ó subunidade.
Segurança
O DCC é um alérgeno potente e sensibilizador, muitas vezes causando erupções cutâneas.
Veja também
Referências
links externos
- Uma excelente ilustração desse mecanismo pode ser encontrada aqui: [1] .