Desalogenação - Dehalogenation
Na química orgânica, a desalogenação é um conjunto de reações químicas que envolvem a clivagem das ligações C-halogênio. As desalogenações vêm em muitas variedades, incluindo desfluoração, descloração, desbrominação e desiodação. Os incentivos para investigar desalogenações incluem objetivos construtivos e destrutivos. Compostos orgânicos complicados, como drogas farmacêuticas, são ocasionalmente gerados por desalogenação. Muitos organohalides são perigosos, então sua desalogenação é um caminho para sua desintoxicação.
Caminhos
A remoção de um átomo de halogênio de um organohalides gera radicais altamente reativos. Esse fato tem várias consequências:
- a monodesalogenação é geralmente acompanhada pelo acoplamento do radical resultante:
- 2 RX + 2 Li → RR + 2LiX
- quando um par de haletos é mutuamente adjacente (vicinal), sua remoção é favorecida. Dihalogenetos de alquil vicinal convertem-se em alquenos. O magnésio pode ser usado:
- R 2 C (X) C (X) R 2 + Mg → R 2 C = CR 2 + MgX 2
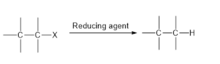
- as desalogenações podem ser efetuadas por hidrogenólise , a substituição de uma ligação CX por uma ligação CH. Essas reações são passíveis de catálise:
- RX + H 2 → RH + HX
Fluoreto vs cloreto vs brometo vs iodeto
A taxa de desalogenação depende da força da ligação entre o carbono e o átomo de halogênio. As energias de dissociação das ligações carbono-halogênio são descritas como: H 3 C-I (234 kJmol-1), H 3 C-Br (293 kJmol-1), H 3 C-Cl (351 kJmol-1) e H 3 CF (452 kJmol-1). Assim, para as mesmas estruturas, a taxa de dissociação da ligação para desalogenação será: F <Cl <Br <I. Além disso, a taxa de desalogenação para halogeneto de alquil também varia com o ambiente estérico e segue esta tendência: halogenetos primários> secundários> terciários.
Formulários
Uma vez que os compostos organoclorados são os organohaletos mais abundantes, a maioria das desalogenações envolve a manipulação das ligações C-Cl.
Metais alcalinos e alcalino-terrosos
Metais altamente eletropositivos reagem com muitos haletos orgânicos em uma troca de metal-halogênio :
- RX + 2 M → RM + MX
O composto organometálico resultante é suscetível à hidrólise:
- RM + H 2 O → RH + H-OH
Exemplos amplamente estudados são encontrados na química do organolítio e na química do organomagnésio . Seguem alguns casos ilustrativos.
A troca de lítio-halogênio fornece uma rota trivial para a desalogenação. O sódio metálico tem sido usado para o processo de desalogenação. A remoção do átomo de halogênio dos haletos de areno na presença do agente de Grignard e da água para a formação do novo composto é conhecida como degradação de Grignard. A desalogenação com reagentes de Grignard é um processo de hidrodesalogenação de duas etapas. A reação começa com a formação do composto alquil / areno-magnésio-halogênio, seguido pela adição da fonte de prótons para formar o produto desalogenado. Egorov e seus colegas relataram a desalogenação de halogenetos de benzila usando magnésio atômico no estado 3P a 600 ° C. Tolueno e bi-benzyls foram produzidos como o produto da reação. Morrison e seus colegas também relataram a desalogenação de haletos orgânicos por pirólise instantânea a vácuo usando magnésio.
Com complexos de metal de transição
Muitos metais de transição de baixa valência e ricos em elétrons efetuam a desalogenação estequiométrica. A reação atinge interesse prático no contexto de síntese orgânica, por exemplo, acoplamento Ullmann promovido por Cu .
Os exemplos podem ser encontrados com vanádio, cromo, manganês e ferro e cobalto. A vitamina B12 e a coenzima F430 foram capazes de desclorar sequencialmente o tetracloroeteno em eteno, enquanto a hematina demonstrou desclorar o tetracloroeteno em cloreto de vinila.
Jayant e seus colegas de trabalho desenvolveram sistemas de duas fases para desalogenação de tricloroetenos. O modelo cinético prevê que o processo de reação ocorra em uma fase, enquanto a transferência de massa entre duas fases.
Leitura adicional
- Gotpagar, J .; Grulke, E .; Bhattacharyya, D .; Desalogenação redutiva de tricloroetileno: modelos cinéticos e * Hetflejš, J .; Czakkoova, M .; Rericha, R .; Vcelak, J. Catalyzed dehalogenation of delor 103 por hidridoaluminato de sódio. Chemosphere 2001, 44, 1521.
- Kagoshima, H .; Hashimoto, Y .; Oguro, D .; Kutsuna, T .; Saigo, K. Combinação de cloreto de trifenilfosfina / germânio (IV): Um novo agente para a redução de derivados de ácido α-bromo carboxílico. Tetrahedron, 1998, 39, 1203-1206