Quitridiomicose - Chytridiomycosis
A quitridiomicose (chy · trid · i · o · my · co · sis | \ kī-ˌtri-dē-ō-mī-ˈkō-səs) é uma doença infecciosa em anfíbios , causada pelo fungo quitrídeo Batrachochytrium dendrobatidis e Batrachochytrium salamandrivorans , um fungo zoospórico não hifal . A quitridiomicose foi associada a declínios populacionais dramáticos ou extinções de espécies de anfíbios no oeste da América do Norte , América Central , América do Sul , leste da Austrália , África Oriental ( Tanzânia ) e Dominica e Montserrat no Caribe . Grande parte do Novo Mundo também corre o risco de a doença chegar nos próximos anos. O fungo é capaz de causar mortes esporádicas em algumas populações de anfíbios e 100% de mortalidade em outras. Nenhuma medida eficaz é conhecida para o controle da doença em populações selvagens. Vários sinais clínicos são vistos pelos indivíduos afetados pela doença. Uma série de opções são possíveis para controlar esse fungo causador de doenças, embora nenhuma tenha se mostrado viável em grande escala. A doença foi proposta como um fator que contribui para o declínio global das populações de anfíbios que aparentemente afetou cerca de 30% das espécies de anfíbios do mundo. Algumas pesquisas encontraram evidências insuficientes para ligar fungos quitrídeos e quitridiomicose aos declínios globais de anfíbios, mas pesquisas mais recentes estabelecem uma conexão e atribuem a propagação da doença à sua transmissão através de rotas de comércio internacional para ecossistemas nativos.
História
Não está claro se a quitridiomicose é um patógeno novo emergente ou um patógeno existente com virulência aumentada recentemente .
A doença em sua forma epizoótica foi descoberta pela primeira vez em 1993 em sapos mortos e moribundos em Queensland , Austrália . Ele estava presente no país desde pelo menos 1978 e está espalhado por toda a Austrália. Também é encontrado na África , Américas , Europa , Nova Zelândia e Oceania . Na Austrália, no Panamá e na Nova Zelândia, o fungo parecia ter "aparecido" repentinamente e expandido seu alcance ao mesmo tempo em que diminuía o número de sapos. Nas Américas, originou-se na Venezuela em 1987, de onde se espalhou pelo continente até a América Central. Também foi encontrado na parte inferior da América Central em 1987, onde se espalhou para baixo para encontrar a varredura ascendente da América do Sul. No entanto, pode ser simplesmente que o fungo ocorra naturalmente e só tenha sido identificado recentemente porque se tornou mais virulento ou mais prevalente no meio ambiente, ou porque as populações hospedeiras tornaram-se menos resistentes à doença. O fungo foi detectado em quatro áreas da Austrália - costa leste, Adelaide , sudoeste da Austrália Ocidental e Kimberley - e provavelmente está presente em outros lugares. Ultimamente, os genomas de 234 isolados de Batrachochytrium dendrobatidis foram comparados filogeneticamente e os resultados sugerem fortemente que uma linhagem encontrada na península coreana provavelmente semeou o panzoótico.
Entre as rãs, a ocorrência mais antiga documentada de Batrachochytrium é de um espécime de uma rã d'água Titicaca coletada em 1863, e entre as salamandras a mais velha era uma salamandra gigante japonesa coletada em 1902. No entanto, ambas essas cepas envolvidas do fungo não foram implicadas em eventos de mortalidade em massa. Um exemplo posterior de um anfíbio infectado com Bd foi um espécime de uma rã africana com garras ( Xenopus laevis ) coletado em 1938, e essa espécie também parece não ser afetada pela doença, o que a torna um vetor adequado . O primeiro método bem documentado de teste de gravidez em humanos envolveu essa espécie e, como resultado, o comércio internacional em grande escala de rãs com garras africanas começou há mais de 60 anos. Se o Batrachochytrium se originou na África, acredita-se que a rã africana com garras tenha sido o vetor de propagação inicial do continente. O primeiro caso documentado da doença quitridiomicose foi uma rã-touro americana ( Rana catesbeiana ) coletada em 1978.
Faixa
A extensão geográfica da quitridiomicose é difícil de determinar. Se ocorrer, a doença só estará presente onde o fungo B. dendrobatidis estiver presente. No entanto, a doença nem sempre está presente onde o fungo está. As razões para o declínio dos anfíbios são frequentemente denominadas 'enigmáticas' porque a causa é desconhecida. Por que algumas áreas são afetadas pelo fungo e outras não, não é totalmente compreendido. Fatores oscilantes como clima, adequação do habitat e densidade populacional podem ser fatores que fazem com que o fungo infecte anfíbios de uma determinada área. Portanto, ao considerar a amplitude geográfica da quitridiomicose, a amplitude de ocorrência de B. dendrobatidis deve ser considerada. A distribuição geográfica de B. dendrobatidis foi recentemente mapeada e abrange grande parte do mundo. B. dendrobatidis foi detectado em 56 de 82 países e em 516 de 1240 (42%) espécies usando um conjunto de dados de mais de 36.000 indivíduos. É amplamente distribuído nas Américas e detectado esporadicamente na África, Ásia e Europa. A Ásia, por exemplo, tem prevalência de apenas 2,35%.
A gama adequada para B. dendrobatidis no Novo Mundo é vasta. As regiões com sua maior adequação incluem habitats que contêm a fauna de anfíbios mais diversa do mundo. As áreas em risco são a floresta ocidental de carvalho de pinho de Sierra Madre, a floresta seca de Sonora e Sinaloan, a floresta úmida de Veracruz, a América Central a leste do istmo de Tehuantepec, as ilhas do Caribe, a floresta temperada no Chile e o oeste da Argentina ao sul de 30 ° S , os Andes acima de 1000 m acima do nível do mar na Venezuela, Colômbia e Equador, encostas orientais dos Andes no Peru e Bolívia, a Mata Atlântica brasileira, Uruguai, Paraguai e nordeste da Argentina, bem como o sudoeste e Madeira-Tapajós amazônica florestas tropicais.
Atualmente, os efeitos da quitridiomicose são vistos mais facilmente na América Central, leste da Austrália, América do Sul e oeste da América do Norte.
Das Alterações Climáticas
Um estudo sugere que as mudanças nas temperaturas globais podem ser responsáveis pelo aumento da proliferação de quitridiomicose. O aumento da temperatura aumentou a evaporação em certos ambientes florestais que, como resultado, promoveu a formação de nuvens. Os especialistas propõem que o aumento da cobertura de nuvens pode, na verdade, diminuir a temperatura diurna ao bloquear o sol, enquanto à noite a cobertura de nuvens serve como isolamento para elevar a temperatura noturna de sua faixa normal. A combinação de temperatura diurna diminuída e temperaturas noturnas aumentadas pode estar proporcionando crescimento e reprodução ideais para o fungo quitrídeo, que tem uma faixa de temperatura preferida entre 63 ° e 77 ° F (17 ° e 25 ° C). O fungo morre em temperaturas acima de 30 ° C, o que sem a cobertura de nuvens do aumento da evaporação é mais facilmente atingido pelo ambiente e pode, portanto, manter mais facilmente a população do fungo sob controle.
Agentes causadores
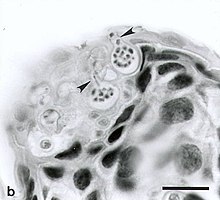
A quitridiomicose causada pelo fungo B. dendrobatidis afeta predominantemente as camadas mais externas da pele contendo queratina. Quando a maioria das espécies atinge um limite de B. dendrobatidis de 10.000 zoósporos, elas não são capazes de respirar, hidratar, osmorregular ou termorregular corretamente. Isso é comprovado por amostras de sangue que mostram falta de certos eletrólitos, como sódio, magnésio e potássio. B. dendrobatidis é atualmente conhecido por ter dois estágios de vida. O primeiro é o estágio zoosporangial assexuado. Quando um hospedeiro contrai a doença pela primeira vez, os esporos penetram na pele e se fixam usando raízes de microtúbulos. O segundo estágio ocorre quando os zoosporângios assexuados iniciais produzem zoósporos móveis. Para dispersar e infectar as células epidérmicas, é necessária uma superfície úmida. Uma segunda espécie de Batrachochytrium , B. salamandrivorans , foi descoberta em 2013 e é conhecida por causar quitridiomicose em salamandras.
Transmissão e progressão da doença
B. dendrobatidis , um patógeno de origem hídrica, dispersa zoósporos no meio ambiente. Os zoósporos usam flagelos para locomoção através dos sistemas de água até que alcancem um novo hospedeiro e entrem cutaneamente. O ciclo de vida de B. dendrobatidis continua até que novos zoósporos sejam produzidos a partir do zoosporângio e saiam para o ambiente ou reinfectem o mesmo hospedeiro. Uma vez que o hospedeiro é infectado com B. dendrobatidis , ele pode potencialmente desenvolver quitridiomicose, mas nem todos os hospedeiros infectados a desenvolvem. Outras formas de transmissão são atualmente desconhecidas; no entanto, postula-se que a quitridiomicose seja transmitida por meio do contato direto dos hospedeiros ou por meio de um hospedeiro intermediário.
Muito de como B. dendrobatidis é transmitido com sucesso de um hospedeiro para o próximo é amplamente desconhecido. Uma vez liberados no ambiente aquático, os zoósporos viajam menos de 2 cm dentro de 24 horas antes de encistarem. A gama limitada de zoósporos de B. dendrobatidis sugere que existe algum mecanismo desconhecido pelo qual eles transmitem de um hospedeiro para o outro, o que pode envolver o comércio de animais de estimação, especialmente a rã-touro americana. Fatores abióticos como temperatura, nível de pH e níveis de nutrientes afetam o sucesso dos zoósporos de B. dendrobatidis . Os zoósporos do fungo podem sobreviver dentro de uma faixa de temperatura de 4–25 ° C e uma faixa de pH de 6–7.
Acredita-se que a quitridiomicose siga este curso: os zoósporos encontram primeiro a pele de anfíbios e rapidamente dão origem aos esporângios , que produzem novos zoósporos. A doença então progride à medida que esses novos zoósporos reinfectam o hospedeiro. As alterações morfológicas em anfíbios infectados com o fungo incluem vermelhidão da pele ventral, convulsões com extensão dos membros posteriores, acúmulos de pele descamada sobre o corpo, descamação da epiderme superficial dos pés e outras áreas, ligeira rugosidade da superfície com minuto marcas na pele e pequenas úlceras ocasionais ou hemorragia . As mudanças comportamentais podem incluir letargia, falha em buscar abrigo, falha em fugir, perda do reflexo de endireitamento e postura anormal (por exemplo, sentar-se com as patas traseiras longe do corpo).
Além de anfíbios, a quitridiomicose também infecta lagostins ( Procambarus alleni , P. clarkii , Orconectes virilis e O. immunis ), mas não peixes mosquitos ( Gambusia holbrooki ).
Sinais clínicos
Os anfíbios infectados com B. dendrobatidis são conhecidos por apresentarem muitos sinais clínicos diferentes. Talvez o primeiro sinal de infecção seja a anorexia, ocorrendo até oito dias após a exposição. Os indivíduos infectados também são comumente encontrados em um estado letárgico, caracterizado por movimentos lentos, e se recusam a se mover quando estimulados. Descamação excessiva da pele é observada na maioria das espécies de rãs afetadas por B. dendrobatidis . Esses pedaços de pele descascada são descritos como opacos, branco-acinzentados e bronzeados. Algumas dessas manchas de pele também estão aderidas à pele dos anfíbios. Esses sinais de infecção costumam ser observados 12-15 dias após a exposição. O sintoma mais típico da quitridiomicose é o espessamento da pele, que leva imediatamente à morte dos indivíduos infectados porque esses indivíduos não conseguem ingerir os nutrientes adequados, liberar toxinas ou, em alguns casos, respirar. Outros sinais comuns são vermelhidão da pele, convulsões e perda do reflexo de endireitamento. Em girinos, B. dendrobatidis afeta o aparelho bucal, onde a queratina está presente, levando a comportamentos alimentares anormais ou descoloração da boca.
Pesquisa e impacto
O fungo quitrídeo anfíbio parece crescer melhor entre 17 e 25 ° C, e a exposição de sapos infectados a altas temperaturas pode curá-los. Na natureza, quanto mais tempo os sapos individuais foram encontrados em temperaturas acima de 25 ° C, menos probabilidade de serem infectados pelo quitrídeo anfíbio. Isso pode explicar por que os declínios de anfíbios induzidos pela quitridiomicose ocorreram principalmente em altitudes mais elevadas e durante os meses mais frios. Peptídeos cutâneos produzidos naturalmente podem inibir o crescimento de B. dendrobatidis quando os anfíbios infectados estão em temperaturas próximas a 10 ° C (50 ° F), permitindo que espécies como a rã-leopardo do norte ( Rana pipiens ) eliminem a infecção em cerca de 15% dos casos .
Embora muitos declínios tenham sido creditados ao fungo B. dendrobatidis - embora provavelmente prematuramente em muitos casos - algumas espécies resistem à infecção e algumas populações podem sobreviver com um baixo nível de persistência da doença. Além disso, algumas espécies que parecem resistir à infecção podem realmente abrigar uma forma não patogênica de B. dendrobatidis .
Alguns pesquisadores afirmam que o foco na quitridiomicose tornou os esforços de conservação dos anfíbios perigosamente míopes. Uma revisão dos dados da Lista Vermelha da IUCN constatou que a ameaça da doença foi presumida na maioria dos casos, mas nenhuma evidência mostra que, de fato, é uma ameaça. Os esforços de conservação na Nova Zelândia continuam a se concentrar na cura da rã de Archey nativa criticamente ameaçada de extinção , Leiopelma archeyi , da quitridiomicose, embora a pesquisa tenha mostrado claramente que eles são imunes à infecção por B. dendrobatidis e estão morrendo na natureza de outros animais mortos- vivos -ser doenças identificadas. Na Guatemala, vários milhares de girinos morreram de um patógeno não identificado distinto de B. dendrobatidis .
Uma revisão científica de 2019 avaliou que a quitridiomicose foi um fator no declínio de pelo menos 501 espécies de anfíbios durante os últimos 50 anos, das quais 90 espécies foram confirmadas ou presumivelmente extintas na natureza e outras 124 diminuíram em número em mais de 90%. A revisão caracterizou o pedágio geral como a "maior perda registrada de biodiversidade atribuível a uma doença". No entanto, um estudo de acompanhamento na Science encontrou o estudo de 2019 de Scheele et al. a falta de evidências necessárias para fazer essas afirmações e concluiu que as conclusões não puderam ser reproduzidas com os dados e métodos do estudo original. Ainda não está claro quantas e quais espécies foram impactadas pela quitridiomicose, mas existem bons dados para um número limitado de espécies, como o sapo de patas amarelas da montanha nas montanhas de Sierra Nevada.
Imunidade
Devido ao imenso impacto do fungo nas populações de anfíbios, pesquisas consideráveis foram realizadas para desenvolver métodos para combater sua proliferação na natureza. Entre as mais promissoras está a revelação de que os anfíbios em colônias que sobrevivem à passagem da epidemia de quitrídeo tendem a carregar níveis mais elevados da bactéria Janthinobacterium lividum . Essa bactéria produz compostos antifúngicos , como o indol-3-carboxaldeído e a violaceína , que inibem o crescimento de B. dendrobatidis mesmo em baixas concentrações. Da mesma forma, a bactéria Lysobacter gummosus encontrada na salamandra de dorso vermelho ( Plethodon cinereus ), produz o composto 2,4-diacetilfloroglucinol que é inibidor do crescimento de B. dendrobatidis . Uma pesquisa de 2021 encontrou uma gama ainda maior de bactérias antifúngicas que vivem em anfíbios.
Compreender as interações das comunidades microbianas presentes na pele dos anfíbios com espécies de fungos no ambiente pode revelar por que certos anfíbios, como a rã Rana muscosa , são suscetíveis aos efeitos fatais de B. dendrobatidis e por que outros, como a salamandra Hemidactylium scutatum , são capazes de coexistir com o fungo. Como mencionado anteriormente, a espécie bacteriana antifúngica Janthinobacterium lividum , encontrada em várias espécies de anfíbios, demonstrou prevenir os efeitos do patógeno mesmo quando adicionada a outro anfíbio que não possui a bactéria ( B. dendrobatidis - espécie de anfíbio suscetível). As interações entre a microbiota cutânea e B. dendrobatidis podem ser alteradas para favorecer a resistência da doença, como visto em estudos anteriores sobre a adição da bactéria produtora de violaceína J. lividum a anfíbios que careciam de violaceína suficiente, permitindo-lhes inibir a infecção. Embora a concentração exata de violaceína (metabólito antifúngico produzido por J. lividum ) necessária para inibir os efeitos de B. dendrobatidis não seja totalmente confirmada, a concentração de violaceína pode determinar se um anfíbio experimentará morbidade (ou mortalidade) causada por B. dendrobatidis . Descobriu-se que a rã Rana muscosa , por exemplo, tem concentrações muito baixas de violaceína em sua pele, embora a concentração seja tão pequena que é incapaz de facilitar o aumento da capacidade de sobrevivência da rã; além disso, J. lividum não foi encontrado na pele de R. muscosa . Isso implica que a bactéria antifúngica J. lividum (nativa da pele de outros anfíbios, como Hemidactylium scutatum ) é capaz de produzir uma quantidade suficiente de violaceína para prevenir a infecção por B. dendrobatidis e permitir a coexistência com o fungo potencialmente mortal.
Um estudo postulou que a pulga d'água Daphnia magna come os esporos do fungo.
Interações com pesticidas
A hipótese de que o uso de pesticidas contribuiu para o declínio das populações de anfíbios foi sugerida várias vezes na literatura. As interações entre os pesticidas e a quitridiomicose foram examinadas em 2007, e a exposição subletal ao pesticida carbaril (um inibidor da colinesterase ) mostrou aumentar a suscetibilidade das rãs de perna amarela ( Rana boylii ) à quitridiomicose. Em particular, as defesas dos peptídeos da pele foram significativamente reduzidas após a exposição ao carbaril, sugerindo que os pesticidas podem inibir essa defesa imune inata e aumentar a suscetibilidade à doença.
Evolução
Sugestões de resistência evolutiva emergente em uma população em recuperação de uma espécie de sapo afetado foram relatados a partir do estudo ecológico de um sapo reprodutor de riachos epizooticamente ameaçado, Mixophyes fleayi, relatado na Austrália subtropical. O rebote de espécies de rãs no Panamá após o declínio não está associado à atenuação do patógeno, mas sim a um fator do hospedeiro - se uma resistência genética evoluída à infecção do fungo ou uma característica adquirida de outra forma (como uma colonização microbiana hipoteticamente protetora) ainda não foi identificada .
Opções de tratamento
O uso de antifúngicos e terapia induzida por calor tem sido sugerido como tratamento de B. dendrobatidis. No entanto, alguns desses antifúngicos podem causar efeitos adversos na pele em certas espécies de rãs e, embora sejam usados para tratar espécies infectadas por quitridiomicose, a infecção nunca é totalmente erradicada. Um estudo feito por Rollins-Smith e colegas sugere que o itraconazol é o antifúngico de escolha quando se trata de tratamento de Bd. Isso é favorecido em comparação com a anfotericina B e o cloranfenicol por causa de sua toxicidade - especificamente o cloranfenicol, pois está correlacionado com a leucemia em sapos. Isso se torna uma situação difícil porque, sem tratamento, as rãs sofrerão de deformidades nos membros e até mesmo a morte, mas também podem sofrer anomalias de pele com o tratamento. “O tratamento nem sempre é 100% bem-sucedido e nem todos os anfíbios toleram o tratamento muito bem, portanto a quitridiomicose deve sempre ser tratada com o conselho de um veterinário”.
Os indivíduos infectados com B. dendrobatidis são banhados em soluções de itraconazol e, em poucas semanas, os indivíduos previamente infectados apresentam resultados negativos para B. dendrobatidis por meio de ensaios de PCR. A terapia por calor também é usada para neutralizar B. dendrobatidis em indivíduos infectados. Experimentos de laboratório com temperatura controlada são usados para aumentar a temperatura de um indivíduo além da faixa de temperatura ideal de B. dendrobatidis . Experimentos, onde a temperatura é aumentada além do limite superior da faixa ótima de B. dendrobatidis de 25 a 30 ° C, mostram que sua presença se dissipará em poucas semanas e os indivíduos infectados retornarão ao normal. A formalina / verde malaquita também tem sido usada para tratar com sucesso indivíduos infectados com quitridiomicose. Um sapo de Archey foi curado com sucesso da quitridiomicose pela aplicação tópica de cloranfenicol. No entanto, os riscos potenciais do uso de drogas antifúngicas em indivíduos são elevados.
A bioaumentação também é considerada como um possível tratamento contra B. dendrobatidis . O anfíbio hospedeiro e até mesmo o ambiente podem ser aumentados com bactérias probióticas que expressam metabólitos antifúngicos que podem combater B. dendrobatidis . Um exemplo de aplicação de probióticos está na espécie Rana muscosa em Sierra Nevada; indivíduos tratados com o probiótico J. lividum exibiram maior sobrevivência e menores cargas de B. dendrobatidis em comparação com controles não tratados. </ref> e espécies endêmicas de rã, a rã Beysehir na Turquia ( Pelophylax caralitanus ).
Veja também
- Doenças infecciosas emergentes
- Síndrome do nariz branco
- Sapo chocando gástrico
- Sapo dourado
- Sapo guajira
- Rabb's Fringe-limbed Treefrog
- Extinção do Holoceno