Carboxilato - Carboxylate
Um carboxilato é a base conjugada de um ácido carboxílico , RCOO - (ou RCO-
2) É um íon com carga negativa .
Os sais de carboxilato são sais que têm a fórmula geral M (RCOO) n , onde M é um metal e n é 1, 2, ...; os ésteres de carboxilato têm a fórmula geral RCOOR ′ (ou RCO 2 R). R e R 'são grupos orgânicos; R ′ ≠ H.
Síntese
Os íons carboxilato podem ser formados por desprotonação de ácidos carboxílicos. Esses ácidos têm tipicamente p K a inferior a 5, o que significa que podem ser desprotonados por muitas bases, como hidróxido de sódio ou bicarbonato de sódio .
- RCOOH + NaOH → RCOONa + H 2 S
Estabilização de ressonância do íon carboxilato
Os ácidos carboxílicos se dissociam facilmente em um ânion carboxilato e um íon de hidrogênio carregado positivamente (próton), muito mais facilmente do que os álcoois (em um íon alcóxido e um próton), porque o íon carboxilato é estabilizado por ressonância . A carga negativa que resta após a desprotonação do grupo carboxila é deslocalizada entre os dois átomos de oxigênio eletronegativos em uma estrutura de ressonância. Se o grupo R for um grupo que retira elétrons (como –CF 3 ), a basicidade do carboxilato será ainda mais enfraquecida.
Essa deslocalização da nuvem de elétrons significa que ambos os átomos de oxigênio têm carga negativa menos forte; o próton positivo é, portanto, menos fortemente atraído de volta para o grupo carboxilato depois que ele sai; portanto, o íon carboxilato é mais estável e menos básico como resultado da estabilização de ressonância da carga negativa. Em contraste, um íon alcóxido , uma vez formado, teria uma forte carga negativa localizada em seu átomo de oxigênio solitário, que atrairia fortemente qualquer próton próximo (de fato, os alcóxidos são bases muito fortes). Por causa da estabilização por ressonância, ácidos carboxílicos têm muito menor p K de valores (e portanto são ácidos mais fortes) do que álcoois . Por exemplo, o valor de p K a do ácido acético é 4,8, enquanto o etanol tem ap K a de 16. Portanto, o ácido acético é um ácido muito mais forte do que o etanol. Isso, por sua vez, significa que para soluções equimolares de um ácido carboxílico e um álcool, o ácido carboxílico teria um pH muito mais baixo .
Reações
Substituição Nucleofílica
Os íons carboxilato são bons nucleófilos . Eles reagem com halogenetos de alquila para formar éster . A seguinte reação mostra o mecanismo de reação.
A nucleofilicidade dos íons carboxilato é muito mais fraca do que a dos íons hidróxido e alcóxido , mas mais forte do que os ânions haleto (em um solvente polar aprótico , embora haja outros efeitos, como a solubilidade do íon).
Redução
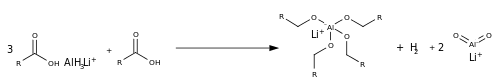
Ao contrário da redução do éster, a redução do carboxilato é diferente, devido à falta do grupo de saída e do átomo de carbono relativamente rico em elétrons (devido à carga negativa nos átomos de oxigênio). Com uma pequena quantidade de ácido, a reação ocorre com hidreto de alumínio e lítio , alterando o LAH no ácido de Lewis AlH 3 no processo, convertendo o oxiânion em 4 ligações Al-O.
Exemplos
Esta lista é para os casos em que existe um artigo separado para o ânion ou seus derivados. Todos os outros ácidos orgânicos devem ser encontrados em seu ácido carboxílico pai.
- Íon formato , HCOO -
- Íon acetato , CH 3 COO -
- Íon metanotetracarboxilato , C (COO - ) 4
-
Íon oxalato , (COO)2−
2