Benzaldeído - Benzaldehyde
|
|
|||
| Nomes | |||
|---|---|---|---|
|
Nome IUPAC
Benzenecarbaldeído
|
|||
|
Nome IUPAC preferido
Benzenecarbaldeído |
|||
| Outros nomes
Benzenocarboxaldeído
Fenilmetanal Aldeído benzóico |
|||
| Identificadores | |||
|
Modelo 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard |
100,002,601 |
||
| Número EC | |||
| KEGG | |||
|
PubChem CID
|
|||
| Número RTECS | |||
| UNII | |||
| Número ONU | 1990 | ||
|
Painel CompTox ( EPA )
|
|||
|
|||
|
|||
| Propriedades | |||
| C 7 H 6 O | |||
| Massa molar | 106,124 g · mol −1 | ||
| Aparência | líquido incolor fortemente refrativo |
||
| Odor | amendoado | ||
| Densidade | 1,044 g / mL, líquido | ||
| Ponto de fusão | −57,12 ° C (−70,82 ° F; 216,03 K) | ||
| Ponto de ebulição | 178,1 ° C (352,6 ° F; 451,2 K) | ||
| 6,95 g / L (25 ° C) | |||
| log P | 1,64 | ||
| -60,78 · 10 −6 cm 3 / mol | |||
|
Índice de refração ( n D )
|
1,5456 | ||
| Viscosidade | 1,321 cP (25 ° C) | ||
| Termoquímica | |||
| -36,8 kJ / mol | |||
| -3525,1 kJ / mol | |||
| Perigos | |||
| Ficha de dados de segurança | JT Baker | ||
| Pictogramas GHS |

|
||
| Palavra-sinal GHS | Aviso | ||
| H302 | |||
| P264 , P270 , P301 + 312 , P330 , P501 | |||
| NFPA 704 (diamante de fogo) | |||
| Ponto de inflamação | 64 ° C (147 ° F; 337 K) | ||
| 192 ° C (378 ° F; 465 K) | |||
| Limites explosivos | 1,4–8,5% | ||
| Dose ou concentração letal (LD, LC): | |||
|
LD 50 ( dose mediana )
|
1300 mg / kg (rato, oral) | ||
| Compostos relacionados | |||
|
Compostos relacionados
|
Álcool benzílico ácido benzóico |
||
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referências da Infobox | |||
O benzaldeído (C 6 H 5 CHO) é um composto orgânico que consiste em um anel de benzeno com um substituinte formil . É o aldeído aromático mais simples e um dos mais úteis industrialmente.
É um líquido incolor com uma característica de amêndoa -like odor . O principal componente do óleo de amêndoa amarga , o benzaldeído pode ser extraído de várias outras fontes naturais. O benzaldeído sintético é o agente aromatizante no extrato de amêndoa de imitação, que é usado para dar sabor a bolos e outros produtos assados.
História
O benzaldeído foi extraído pela primeira vez em 1803 pelo farmacêutico francês Martrès. Seus experimentos se concentraram em elucidar a natureza da amigdalina , o material venenoso encontrado nas amêndoas amargas , fruto do Prunus dulcis . Outros trabalhos sobre o óleo de Pierre Robiquet e Antoine Boutron-Charlard, dois químicos franceses, produziram benzaldeído. Em 1832, Friedrich Wöhler e Justus von Liebig sintetizaram o benzaldeído pela primeira vez.
Produção
Em 1999, 7000 toneladas de benzaldeído sintético e 100 toneladas de natural foram produzidas anualmente. A cloração em fase líquida e a oxidação do tolueno são as principais vias. Vários outros métodos foram desenvolvidos, como a oxidação parcial do álcool benzílico , a hidrólise alcalina do cloreto de benzal e a carbonilação do benzeno.
Uma quantidade significativa de benzaldeído natural é produzida a partir do cinamaldeído obtido do óleo de cássia pela reação de retroaldol : o cinamaldeído é aquecido em uma solução aquosa / alcoólica entre 90 ° C e 150 ° C com uma base (mais comumente carbonato de sódio ou bicarbonato ) por 5 a 80 horas, seguido por destilação do benzaldeído formado. Esta reação também produz acetaldeído . O estado natural do benzaldeído obtido dessa forma é controverso. Alguns outros alimentos estão sujeitos a condições reativas inegavelmente maiores, como a farinha de masa, que é feita tratando a farinha de milho com hidróxido de sódio (soda cáustica). Quando o alimento é cozido, ele é freqüentemente alterado pelas condições de oxidação catalítica no cozimento, que podem até transmitir alguma toxicidade (embora insignificante). Ainda assim, submeter o cinamaldeído à reação retroaldólica é, sem dúvida, uma conversão química em uma substância química distintamente separada.
" Espectroscopia de ressonância magnética nuclear específica do local ", que avalia as razões de isótopos 1 H / 2 H, tem sido usada para diferenciar entre o benzaldeído de ocorrência natural e o sintético.
Ocorrência
O benzaldeído e produtos químicos semelhantes ocorrem naturalmente em muitos alimentos. A maior parte do benzaldeído que as pessoas comem é de alimentos vegetais naturais, como amêndoas .
Amêndoas, damascos , maçãs e grãos de cereja contêm quantidades significativas de amigdalina . Este glicosídeo se quebra sob catálise enzimática em benzaldeído, cianeto de hidrogênio e dois equivalentes de glicose .
O benzaldeído contribui para o perfume dos cogumelos ostra ( Pleurotus ostreatus ).
Reações
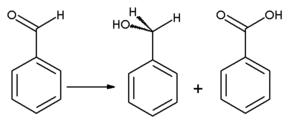
O benzaldeído pode ser oxidado em ácido benzóico ; de fato, "o [B] enzaldeído prontamente sofre autoxidação para formar ácido benzóico na exposição ao ar em temperatura ambiente" causando uma impureza comum em amostras de laboratório. Uma vez que o ponto de ebulição do ácido benzóico é muito maior do que o do benzaldeído, ele pode ser purificado por destilação . O álcool benzílico pode ser formado a partir do benzaldeído por meio de hidrogenação . A reação do benzaldeído com acetato de sódio anidro e anidrido acético produz ácido cinâmico , enquanto o cianeto de potássio alcoólico pode ser usado para catalisar a condensação do benzaldeído em benjoim . O benzaldeído sofre desproporcionamento após o tratamento com álcali concentrado ( reação de Cannizzaro ): uma molécula do aldeído é reduzida a álcool benzílico e outra molécula é simultaneamente oxidada a ácido benzóico .
Com dióis, incluindo muitos açúcares, o benzaldeído se condensa para formar acetais de benzilideno .
Usos
O benzaldeído é comumente empregado para conferir sabor de amêndoa a alimentos e produtos perfumados. Às vezes é usado em produtos cosméticos.
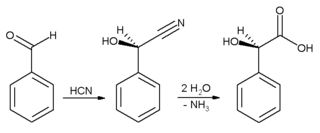
Em ambientes industriais, o benzaldeído é usado principalmente como um precursor de outros compostos orgânicos, que vão desde produtos farmacêuticos a aditivos plásticos. O corante anilina verde malaquita é preparado a partir de benzaldeído e dimetilanilina . O benzaldeído também é um precursor de certos corantes de acridina . Por condensação aldólica , o benzaldeído é convertido em derivados de cinamaldeído e estireno . A síntese do ácido mandélico começa com a adição de ácido cianídrico ao benzaldeído:
A cianoidrina resultante é hidrolisada em ácido mandélico . (O esquema acima descreve apenas um dos dois enantiômeros formados ).
Nicho usa
O benzaldeído é usado como repelente de abelhas . Uma pequena quantidade de solução de benzaldeído é colocada em uma placa de vapores perto dos favos de mel. As abelhas então se afastam dos favos de mel para evitar a fumaça. O apicultor pode então remover os quadros de mel da colmeia com menos risco para as abelhas e o apicultor.
Além disso, o benzaldeído também é usado como um produto químico aromatizante nas vagens dos cigarros eletrônicos JUUL , particularmente nas variedades "Cool Mint", "Cool Cucumber" e "Fruit Medley". A concentração é relativamente baixa, em ~ 1 μg / mL.
Segurança
Como usado em alimentos, cosméticos, produtos farmacêuticos e sabão, o benzaldeído é "geralmente considerado como seguro" ( GRAS ) pelo FDA e FEMA dos EUA . Esse status foi reafirmado após uma revisão em 2005. É aceito na União Europeia como um agente aromatizante. Estudos toxicológicos indicam que é seguro e não cancerígeno nas concentrações utilizadas para alimentos e cosméticos, podendo até ter propriedades anticancerígenas (anticancerígenas).
Para um ser humano de 70 kg, a dose letal é estimada em 50 mL. Uma ingestão diária aceitável de 15 mg / dia foi identificada para o benzaldeído pela Agência de Proteção Ambiental dos Estados Unidos . O benzaldeído não se acumula nos tecidos humanos. É metabolizado e depois excretado na urina.
Referências
links externos
- Cartão Internacional de Segurança Química 0102
- Relatório de avaliação inicial do SIDS para benzaldeído da Organização para Cooperação e Desenvolvimento Econômico (OCDE) Arquivado
- Descrição do benzaldeído em ChemicalLand21.com
- ChemSub Online: Benzaldéhyde.
- Projeto de Potência de Carcinogenicidade