Reação de Belousov-Zhabotinsky - Belousov–Zhabotinsky reaction
Uma reação de Belousov-Zhabotinsky , ou reação BZ , faz parte de uma classe de reações que servem como um exemplo clássico de termodinâmica de não equilíbrio , resultando no estabelecimento de um oscilador químico não linear . O único elemento comum nesses osciladores é a inclusão de bromo e um ácido. As reações são importantes para a química teórica, pois mostram que as reações químicas não precisam ser dominadas pelo comportamento termodinâmico de equilíbrio . Essas reações estão longe do equilíbrio e assim permanecem por um período de tempo significativo e evoluem caoticamente . Nesse sentido, eles fornecem um modelo químico interessante de fenômenos biológicos de não-equilíbrio; como tal, modelos matemáticos e simulações das próprias reações de BZ são de interesse teórico, apresentando fenômenos como ordem induzida por ruído .
Um aspecto essencial da reação BZ é sua chamada "excitabilidade"; sob a influência de estímulos, os padrões se desenvolvem no que, de outra forma, seria um meio perfeitamente quiescente. Algumas reações do relógio, como Briggs – Rauscher e BZ, usando o cloreto de tris (bipiridina) rutênio (II) como catalisador, podem ser estimuladas a uma atividade auto-organizada por meio da influência da luz.
História
A descoberta do fenômeno é creditada a Boris Belousov . Em 1951, ao tentar encontrar o análogo não orgânico do ciclo de Krebs , ele notou que em uma mistura de bromato de potássio , sulfato de cério (IV) , ácido malônico e ácido cítrico em ácido sulfúrico diluído , a proporção da concentração do Os íons cério (IV) e cério (III) oscilavam, fazendo com que a cor da solução oscilar entre uma solução amarela e uma solução incolor. Isso se deve ao fato dos íons cério (IV) serem reduzidos pelo ácido malônico a íons cério (III), que são então oxidados de volta aos íons cério (IV) pelos íons bromato (V).
Belousov fez duas tentativas para publicar sua descoberta, mas foi rejeitado com o fundamento de que ele não poderia explicar seus resultados para a satisfação dos editores dos periódicos aos quais ele submeteu seus resultados. O bioquímico soviético Simon El'evich Shnoll encorajou Belousov a continuar seus esforços para publicar seus resultados. Em 1959, seu trabalho foi finalmente publicado em um jornal menos respeitável e não revisado.
Após a publicação de Belousov, Shnoll deu o projeto em 1961 a um estudante graduado, Anatol Zhabotinsky , que investigou a sequência da reação em detalhes; no entanto, os resultados do trabalho desses homens ainda não eram amplamente divulgados e não eram conhecidos no Ocidente até uma conferência em Praga em 1968.
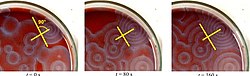
Vários coquetéis BZ estão disponíveis na literatura química e na web. Ferroin , um complexo de fenantrolina e ferro , é um indicador comum . Essas reações, se realizadas em placas de Petri , resultam na formação primeiro de manchas coloridas. Esses pontos crescem em uma série de anéis concêntricos em expansão ou talvez espirais em expansão semelhantes aos padrões gerados por um autômato celular cíclico . As cores desaparecem quando os pratos são agitados e reaparecem. As ondas continuam até que os reagentes sejam consumidos. A reação também pode ser realizada em um copo usando um agitador magnético .
Andrew Adamatzky , um cientista da computação da Universidade do Oeste da Inglaterra , relatou sobre portas lógicas líquidas usando a reação BZ. A reação BZ também foi usada por Juan Pérez-Mercader e seu grupo na Universidade de Harvard para criar uma máquina de Turing totalmente química, capaz de reconhecer uma linguagem de Chomsky tipo 1 .
Padrões espirais oscilatórios surpreendentemente semelhantes aparecem em outras partes da natureza, em escalas espaciais e temporais muito diferentes, por exemplo, o padrão de crescimento de Dictyostelium discoideum , uma colônia de ameba que vive no solo . Na reação BZ, o tamanho dos elementos interagentes é molecular e a escala de tempo da reação é de minutos. No caso da ameba do solo, o tamanho dos elementos é típico de organismos unicelulares e os tempos envolvidos são da ordem de dias a anos.
Os investigadores também estão explorando a criação de um "computador úmido", usando "células" autocriadas e outras técnicas para imitar certas propriedades dos neurônios .
Mecanismo químico
O mecanismo para essa reação é muito complexo e acredita-se que envolva cerca de 18 etapas diferentes que foram objeto de uma série de trabalhos de pesquisa.
De maneira semelhante à reação de Briggs – Rauscher , ocorrem dois processos-chave (ambos autocatalíticos ); o processo A gera bromo molecular, dando a cor vermelha, e o processo B consome o bromo para dar íons brometo. Teoricamente, a reação se assemelha ao padrão de Turing ideal , um sistema que emerge qualitativamente da solução das equações de difusão de reação para uma reação que gera um inibidor de reação e um promotor de reação, dos quais os dois se difundem através do meio em taxas diferentes.
Uma das variações mais comuns dessa reação usa ácido malônico (CH 2 (CO 2 H) 2 ) como ácido e bromato de potássio (KBrO 3 ) como fonte de bromo. A equação geral é:
- 3 CH 2 (CO 2 H) 2 + 4 BrO-
3→ 4 Br - + 9 CO 2 + 6 H 2 O
Variantes
Existem muitas variantes da reação. O único produto químico chave é o oxidante do bromato. O íon catalisador é mais frequentemente cério, mas também pode ser manganês ou complexos de ferro, rutênio, cobalto, cobre, cromo, prata, níquel e ósmio. Muitos redutores diferentes podem ser usados. (Zhabotinsky, 1964b; Field e Burger, 1985)
Muitos padrões diferentes podem ser observados quando a reação é executada em uma microemulsão .
Veja também
- Autowave
- Reverberador Autowave
- Reação de Briggs – Rauscher
- Dissipação
- Meio excitável
- Ordem induzida por ruído
- Padrões na natureza
- Reação-difusão
- Auto-oscilação
- Auto-organização
- Alan Turing, que previu matematicamente reações químicas oscilantes no início dos anos 1950
- Brusselator
- Oregonator
Referências
Leitura adicional
- Strogatz, S. (2003). SYNC, a ciência emergente da ordem espontânea . Hyperion. pp. 212–216, 219. ISBN 0-7868-6844-9.
- Pabian, RK; Zarins, A. Banded Agates, Origins and Inclusions . Circular Educacional. 12 . Universidade de Nebraska-Lincoln.
- Ichino, T .; Asahi, T .; Kitahata, H .; Magome, N .; Agladze, K .; Yoshikawa, K. (2008). "Microfreight Delivered by Chemical Waves". Journal of Physical Chemistry C . 112 (8): 3032–5. doi : 10.1021 / jp7097922 .
links externos
- Experiência científica interativa mostrando a reação BZ (nível A)
- Um artigo de pesquisa sobre a matemática da reação BZ
- O artigo da Scholarpedia sobre a reação Belousov-Zhabotinsky
- A reação de Belousov-Zhabotinski
- A reação de Belousov-Zhabotinsky
- A fenomenologia da reação de Belousov-Zhabotinsky, com fotos
- Reação e explicação de BZ na Tabela Periódica de Vídeos
- A reação de Belousov-Zhabotinski (arquivo PDF)
- "A carga de papel surfa ondas químicas" - Ondas químicas em movimento induzidas por reações BZ podem impulsionar pequenos objetos, New Scientist , 18 de fevereiro de 2008
- A página inicial de Anatol M. Zhabotinsky
- Simulando reações de Belousov-Zhabotinsky no Pixel Bender Uma simulação da reação de Belousov-Zhabotinsky em execução no Flash Player