Trissulfeto de antimônio - Antimony trisulfide
|
|

|
|
| Nomes | |
|---|---|
|
Nome IUPAC
trissulfeto de diantimônio, sulfeto de antimônio (III)
|
|
| Outros nomes
sulfeto de antimônio, sulfeto de antimônio, sesquisulfeto de antimônio, vermelhão de antimônio, antimônio preto, enxofre de antimônio
|
|
| Identificadores | |
|
Modelo 3D ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.014.285 |
|
PubChem CID
|
|
| UNII | |
|
Painel CompTox ( EPA )
|
|
|
|
|
|
| Propriedades | |
| Sb 2 S 3 | |
| Massa molar | 339,715 |
| Aparência | cristal ortorrômbico cinza / preto (estibnita) |
| Densidade | 4,562g cm −3 (estibnita) |
| Ponto de fusão | 550 ° C (1.022 ° F; 823 K) (estibnita) |
| Ponto de ebulição | 1.150 ° C (2.100 ° F; 1.420 K) |
| 0,00017 g / 100 mL (18 ° C) | |
| -86,0 · 10 −6 cm 3 / mol | |
|
Índice de refração ( n D )
|
4.046 |
| Termoquímica | |
|
Capacidade de calor ( C )
|
123,32 J / K mol |
| -157,8 kJ / mol | |
| Perigos | |
| NFPA 704 (diamante de fogo) | |
| Dose ou concentração letal (LD, LC): | |
|
LD 50 ( dose mediana )
|
> 2000 mg / kg (rato, oral) |
| NIOSH (limites de exposição à saúde dos EUA): | |
|
PEL (permitido)
|
TWA 0,5 mg / m 3 (como Sb) |
|
REL (recomendado)
|
TWA 0,5 mg / m 3 (como Sb) |
| Compostos relacionados | |
|
Outros ânions
|
Trióxido de antimônio Antimônio trisselenídeo Telureto de antimônio |
|
Outros cátions
|
Trissulfeto de arsênio Sulfeto de bismuto (III) |
|
Compostos relacionados
|
Pentassulfeto de antimônio |
|
Exceto onde indicado de outra forma, os dados são fornecidos para materiais em seu estado padrão (a 25 ° C [77 ° F], 100 kPa). |
|
| Referências da Infobox | |
O trissulfeto de antimônio (Sb 2 S 3 ) é encontrado na natureza como o mineral cristalino estibnita e o mineral vermelho amorfo (na verdade, um mineralóide) metastibnita . É fabricado para uso em fósforos de segurança , munições militares, explosivos e fogos de artifício. Também é usado na produção de vidro cor de rubi e em plásticos como retardante de chamas. Historicamente, a forma estibnita foi usada como pigmento cinza em pinturas produzidas no século XVI. O trissulfeto de antimônio também foi usado como fotocondutor sensível à imagem em tubos de câmera de vidicon . É um semicondutor com um gap direto de 1,8–2,5 eV. Com dopagem adequada, materiais do tipo p e n podem ser produzidos.
Preparação e reações
Sb 2 S 3 pode ser preparado a partir dos elementos em temperatura 500–900 ° C:
- 2 Sb + 3 S → Sb 2 S 3
Sb 2 S 3 é precipitado quando H 2 S é passado através de uma solução acidificada de Sb (III). Esta reacção tem sido utilizada como um método gravimétrico para a determinação de antimónio, borbulhando H 2 S através de uma solução de Sb composto (III) em quentes HCl depósitos uma forma de laranja de Sb 2 S 3 que fica preta sob as condições de reacção.
Sb 2 S 3 é facilmente oxidado, reagindo vigorosamente com agentes oxidantes. Ele queima no ar com uma chama azul. Reage com a incandescência com cloratos de cádmio, magnésio e zinco. Misturas de Sb 2 S 3 e cloratos podem explodir.
Na extração de antimônio de minérios de antimônio, o processo de sulfeto alcalino é empregado, onde Sb 2 S 3 reage para formar sais de tioantimonato (III) (também chamados de tioantimonita):
- 3 Na 2 S + Sb 2 S 3 → 2 Na 3 SbS 3
Uma série de sais contendo diferentes íons tioantimonato (III) podem ser preparados a partir de Sb 2 S 3, incluindo:
- [SbS 3 ] 3− , [SbS 2 ] - , [Sb 2 S 5 ] 4− , [Sb 4 S 9 ] 6− , [Sb 4 S 7 ] 2− e [Sb 8 S 17 ] 10−
" Sal de Schlippe ", Na 3 SbS 4 · 9H 2 O, um sal tioantimonato (V) é formado quando Sb 2 S 3 é fervido com enxofre e hidróxido de sódio. A reação pode ser representada como:
- Sb 2 S 3 + 3 S 2− + 2 S → 2 [SbS 4 ] 3−
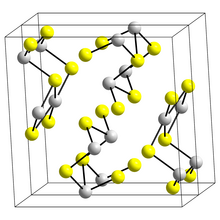
Estrutura
A estrutura da forma preta semelhante a uma agulha de Sb 2 S 3 , estibnita , consiste em fitas ligadas nas quais os átomos de antimônio estão em dois ambientes de coordenação diferentes, trigonal piramidal e quadrada piramidal. Fitas semelhantes ocorrem em Bi 2 S 3 e Sb 2 Se 3 . A forma vermelha, metastibnita, é amorfa. Trabalhos recentes sugerem que há uma série de estruturas de estibnita dependentes da temperatura intimamente relacionadas que foram denominadas estibnita (I) a forma de alta temperatura, identificada anteriormente, estibnita (II) e estibnita (III). Outro artigo mostra que os poliedros de coordenação reais do antimônio são de fato SbS 7 , com (3 + 4) coordenação no local M1 e (5 + 2) no local M2. Essas coordenações consideram a presença de vínculos secundários. Algumas das ligações secundárias conferem coesão e estão conectadas com embalagem.

